quinta-feira, 3 de julho de 2014
domingo, 29 de junho de 2014
A IMPORTÃNCIA DE EXPLICAR A CIÊNCIA DE MODO ACESSÍVEL A TODOS
A curiosidade é a porta de entrada para o mundo maravilhoso das ciências. De simples perguntas a questionamentos complexos, as pessoas buscam entender o que veem. Por isso, colocar o conhecimento científico ao alcance de todos os públicos-alvo é uma tarefa nobre daqueles que se dedicam a ela, para que as pessoas que perguntam não fiquem apenas com a impressão de que tudo é magia, afinal, tudo é ciência.
Uma boa semana a todos é o que desejamos.
(Arte: Brace)
quinta-feira, 26 de junho de 2014
SUPER INTERESSANTE
10 fenômenos naturais muito interessantes
De pedras que deslizam sozinhas a pilares de luz, a natureza é surpreendente
Caranguejos aos milhares, pedras que se movem sozinhas e nuvens incríveis. O mundo é cheio de surpresas. Veja 10 fenômenos naturais que são muito interessantes.
RACHADURAS NAS PAREDES DO UNIVERSO
Depois do céu, tem outro céu. Sem estrelas. Se você voar alto o bastante, uma hora sai da Via Láctea. As estrelas vão ficar lá embaixo, confinadas em braços espirais. Mas ainda vai existir um céu, e ele será pontilhado de galáxias. E depois desse céu, tem outro céu. Sem galáxias.
domingo, 22 de junho de 2014
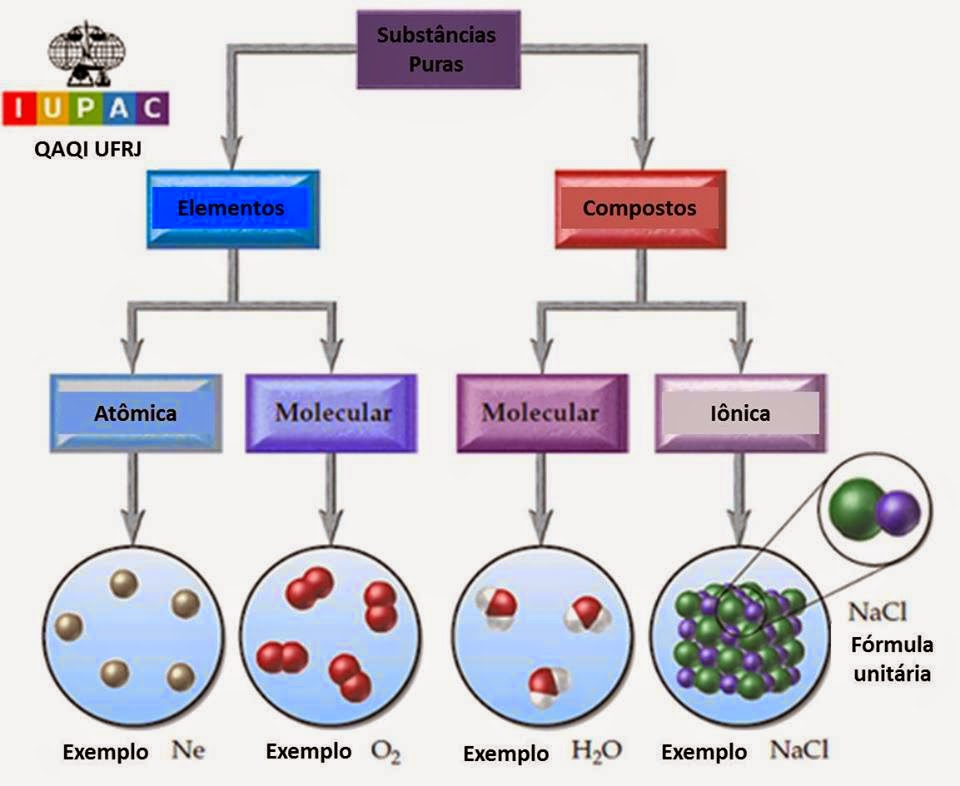
SUBSTÂNCIAS PURAS
DISTINÇÃO ENTRE AS
SUBSTÂNCIAS PURAS
Segundo a IUPAC
A União
Internacional de Química Pura e Aplicada editou este esquema (que traduzimos)
que diferencia as diversas substâncias puras, as quais se classificam
inicialmente em simples ou elementares (formadas por um só elemento químico) e compostas (onde aparecem
dois ou mais elementos em sua composição). Num segundo nível de distinção, as
substâncias puras compostas de um só elemento se dividem em atômicas e
moleculares. As substâncias atômicas corresponderiam a espécies moleculares que
contém apenas um átomo. Já as substâncias compostas se dividem em moleculares
ou iônicas, conforme o tipo de ligação existente (covalente ou iônica,
respectivamente).
É uma boa compreender bem este diagrama.
ESCALA DE pH
Em 1909, um bioquímico dimarmaquês, Søren Peder
Lauritz Sorensen (1868-1939) estabeleceu uma definição para expressar a
concentração de íons hidrogênio em solução aquosa: pH = - log[H+],
evitando com isso o uso de
números muito pequenos, cheios de zeros à esquerda.
Analogamente,
pOH = - log[OH-]. Com base no chamado produto iônico da água (Kw),
que já havia sido determinado anos antes:
[H+]
x [OH-] = 1,008 x 10-14 (~1 x 10-14) a 25oC
ao
aplicar a definição de Sorensen, temos:
log {[H+] x [OH-]} = log 1 x 10-14
log[H+] + log[OH-] = -14
- pH - pOH = -14.
log {[H+] x [OH-]} = log 1 x 10-14
log[H+] + log[OH-] = -14
- pH - pOH = -14.
Por fim, pH +
pOH = 14.
O gráfico desta postagem mostra como as concentrações de H+ e de OH- variam inversamente em uma solução aquosa, pois o produto delas deve ser 10-14 a 25oC. Com o emprego do indicador tornassol, se houver predominância de íons H+, o indicador assume a cor vermelha, e diz-se que a solução é ácida. Caso haja predominância de íons OH-, a cor do indicador passa a ser azul, e a solução é alcalina ou básica. A neutralidade corresponde ao pH 7, pois [H+] = [OH-].
EQUILÍBRIO QUÍMICO
EQUILÍBRIO CO2 - HIDROGENOCARBONATO - BICARBONATO
É importante conhecer
A justificativa à
afirmação acima se baseia em fatos como:
a) Os pares CO2/HCO3-
e HCO3-/CO32- são sistemas tampão
que existem na natureza em inúmeras situações e fluidos biológicos, como o sangue humano;
b) A dissolução de uma maior quantidade de CO2
nos mares tende a acidificar as águas, colocando em risco formas de vida
dependentes de cálcio como os corais e organismos que têm conchas;
c) Os carbonatos minerais naturais como calcita
(CaCO3) e magnesita (MgCO3) só existem na medida em que o
chamado "ambiente de deposição" da jazida é alcalino. Em contato com
ácidos decompõem-se liberando CO2;
d) Os comprimidos efervescentes contêm
carbonato/hidrogenocarbonato e um ácido (geralmente o cítrico) no estado
sólido; ao entrar em contato com a água, o ácido decompõe os carbonatos
produzindo CO2.
Esses fatos não são os únicos, mas são suficientes
para compreender a importância deste equilíbrio em nossa vida, e o emprego
frequente deste tema em provas de Química e Biologia.
A pressão atmosférica o CO2 é pouco
solúvel em água, a solução saturada a 25oC contém 0,05 mol/L (2,2
g/L). Praticamente todo o CO2 está na forma original, e uma pequena
fração é convertida em ácido carbônico (H2CO3), pois o CO2
é um óxido ácido, formado por não metais:
CO2 + H2O → H2CO3
Acompanhemos a figura. A medida que se adiciona
base forte como NaOH, o pH sobre e começa a neutralização do primeiro H
ionizável do ácido carbônico:
H2CO3 + OH- → HCO3- + H2O
Forma-se o íon hidrogenocarbonato, mais conhecido
como bicarbonato.
Em pH em torno de 8,2, temos apenas íons HCO3-
(veja a figura). A adição de mais NaOH começa a gerar uma mistura de HCO3-
e CO32- (íons carbonato):
HCO3- + OH- → CO32-
+ H2O
Em pH a partir de ~12 somente o CO32-
aparece em quantidades significativas.
Esta postagem é uma adaptação do original publicado
pela página parceira de Planeta Bio, Química
Analítica Qualitativa Inorgânica UFRJ.
Assinar:
Comentários (Atom)